US-Arzneibehörde bezweifelt Wirkung von Anti-Corona-Präparat
Das Corona-Präparat Evusheld könnte laut US-Arzneimittelbehörde FDA gegen die neue Variante XBB.1.5 unwirksam sein. Man müsse weitere Daten abwarten.
Das Wichtigste in Kürze
- Die US-Arzneimittelbehörde zweifelt daran, dass Evusheld gegen XBB.1.5 wirkt.
- Das Anti-Corona-Präparat wurde für Personen zugelassen, die nicht geimpft werden können.
- Die Variante XBB.1.5 ist aktuell auf dem Vormarsch und macht rund 28% der US-Fälle aus.
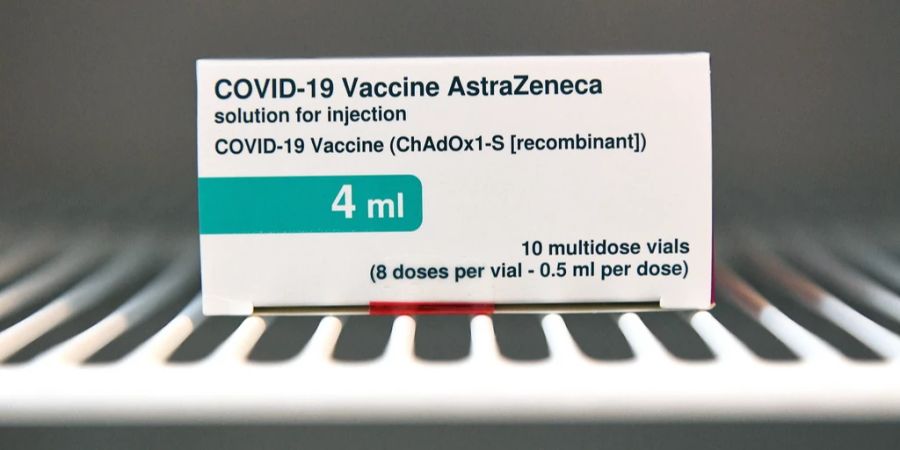
Die US-Arzneibehörde FDA bezweifelt die Wirksamkeit des Antikörper-Präparats Evusheld im Kampf gegen die neue Coronavirus-Variante XBB.1.5. Auch wenn noch auf Daten gewartet werden müsse, gehe man derzeit davon aus, dass das Präparat von Astrazeneca die Variante wohl nicht unschädlich mache, teilte die FDA am Freitag mit.
Das bedeute, dass Evusheld möglicherweise keinen Schutz biete. Derzeit mache XBB.1.5 rund 28 Prozent aller in den USA zirkulierenden Varianten aus.
Präparat als Lösung für Personen, die nicht geimpft werden können, angesehen
Im August hatte die deutsche Ständige Impfkommission (Stiko) besonders vulnerablen Gruppen ab 12 Jahren zusätzlich zur Impfung das Antikörper-Präparat Evusheld als Präventionsmassnahme empfohlen. Evusheld besteht aus zwei Sars-CoV-2-neutralisierenden Antikörpern und kann in den Muskel gespritzt werden.
Die Empfehlung gilt für Menschen, bei denen aus bestimmten Gründen keine Impfungen gegen Covid-19 erfolgen können und die zugleich Risikofaktoren für einen schweren Krankheitsverlauf haben.
Am Mittwoch hatte sich bereits die Weltgesundheitsorganisation (WHO) besorgt über die neue Coronavirus-Variante gezeigt. Die im Oktober entdeckte Variante sei so leicht übertragbar wie keine der bisher bekannten Varianten, hiess es. Sie breite sich nach den vorliegenden Gen-Analysen des Virus vor allem in den USA und Europa aus und sei bereits in 29 Ländern nachgewiesen worden. Es handele sich um eine Untergruppe der seit Ende 2021 zirkulierenden Omikron-Variante. Eine Risikoanalyse sei in Arbeit und werde in Kürze veröffentlicht.