USA erlauben Einsatz von Ebola-Wirkstoff Remdesivir bei Coronavirus
Die USA erlauben den begrenzten Einsatz des Wirkstoffs Remdesivir bei Covid-19-Patienten in Spitälern.

Das Wichtigste in Kürze
- Die USA erlauben den Einsatz von Remdesivir im Kampf gegen das Coronavirus.
- Der Wirkstoff wurde ursprünglich für Ebola entwickelt.
Die USA erlauben den begrenzten Einsatz des Wirkstoffs Remdesivir bei Covid-19-Patienten in Spitälern. Die Ausnahmegenehmigung sei angesichts der Coronavirus-Pandemie «in Lichtgeschwindigkeit» zustande gekommen.
Dies sagte der Chef der Lebensmittel- und Arzneimittelbehörde, Stephen Hahn, am Freitag im Weissen Haus.
US-Präsident Donald Trump bezeichnete den Schritt als «sehr vielversprechend». Eine klinische Studie hatte zuvor gezeigt, dass der ursprünglich für Ebola entwickelte Wirkstoff bei Covid-Patienten die Zeit bis zu einer Genesung um mehrere Tage verkürzen kann.
US-Regierung übernimmt Verteilung
Der Chef des Biotech-Unternehmens Gilead, Daniel O'Day, erklärte, das Unternehmen werde US-Behörden 1,5 Millionen Dosen Remdesivir spenden, die für mehr als 100'000 Behandlungen ausreichen sollten. Patienten, die an der Lungenkrankheit Covid-19 litten, könnten das Medikament nun je nach Schwere der Erkrankung fünf oder zehn Tage lang bekommen, erklärte Gilead.
Die US-Regierung werde die Verteilung des Medikaments übernehmen, um sicherzustellen, dass es ankomme, wo es am dringendsten gebraucht werde, hiess es weiter. Bis Dezember wolle man genügend Remdesivir für eine Million Behandlungen produzieren.
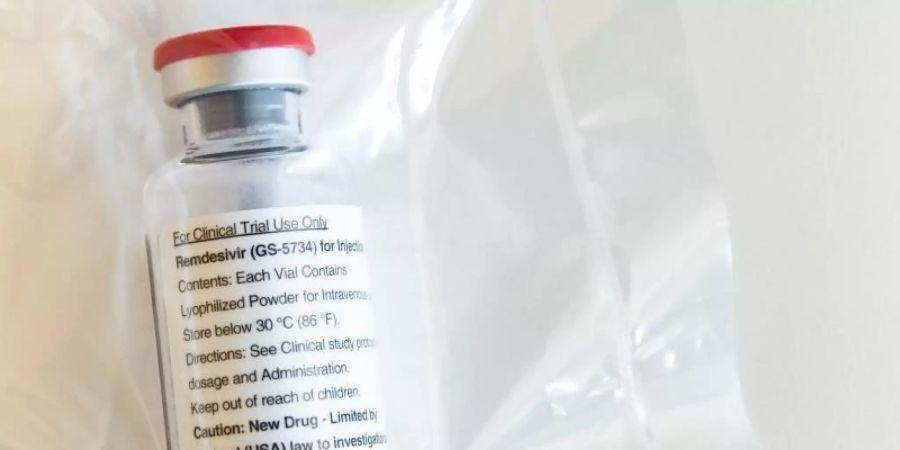
Remdesivir ist bisher weltweit nirgendwo als Medikament zugelassen. Die Ausnahmegenehmigung für die USA entspricht keiner formellen Zulassung, was ein wesentlich aufwendigerer Prozess ist. Selbst die Ausstellung einer begrenzten Ausnahmegenehmigung nach nur einer vielversprechenden klinischen Studie ist ungewöhnlich. Bisher gibt es jedoch keine Impfung gegen das neuartige Coronavirus und auch keine zuverlässige zugelassene medikamentöse Therapie.
Behandlungsdauer deutlich verkürzt
Am Mittwoch hatte das Nationalen Institut für Infektionskrankheiten (NIAID) der USA erklärt, Remdesivir habe im Rahmen einer klinischen Studie die Behandlungsdauer deutlich verkürzt. Institutsleiter Anthony Fauci sprach von einer «signifikanten positive Wirkung bei der Verringerung der Zeit bis zur Genesung».

Die Studie mit mehr als 1000 Teilnehmern sei mit Kontrollgruppen durchgeführt worden, die Datenerhebung hätten unabhängige Experten begleitet. Patienten mit der vom Coronavirus verursachten Lungenkrankheit Covid-19 waren Fauci zufolge nach durchschnittlich 11 Tagen wieder genesen, die Patienten der Kontrollgruppe hingegen erst nach 15 Tagen.
Die Resultate müssten noch unabhängig geprüft und veröffentlicht werden, schränkte Fauci ein. Zudem führte das Medikament nur zu einer geringfügig niedrigeren Sterblichkeitsrate.
Nach Ansicht vieler Experten scheinen die Ergebnisse der US-Studie ausreichend belastbar. Remdesivir hatte zuvor in Laborversuchen einige Wirksamkeit gegen das neuartige Coronavirus Sars-CoV-2 gezeigt. In Tierversuchen wirkte es gegen andere Coronavirus-Infektionen wie Sars und Mers.