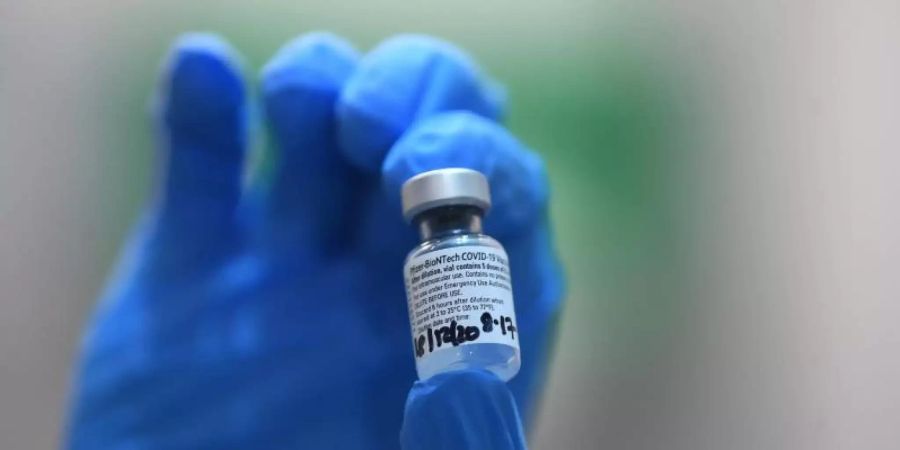
WHO erteilt Notfall-Zulassung für Corona-Impfstoff von Biontech
Nach der Zulassung des Biontech-Corona-Impfstoffs in mehreren Ländern hat auch die Weltgesundheitsorganisation (WHO) grünes Licht für den Einsatz gegeben.
Das Wichtigste in Kürze
- Der Impfstoff von Biontech und Pfizer hat von der WHO eine Notfallzulassung erhalten.
- Der Nutzen eines Einsatzes wiegt die möglichen Risiken auf, wird der Entscheid begründet.
Die Weltgesundheitsorganisation WHO hat am Silvestertag eine Notfallzulassung erteilt, wie sie in Genf mitteilte. Die WHO drängte auf eine gerechte Verteilung des Impfstoffs in allen Ländern der Welt.
Die WHO prüft wie die Regulierungsbehörden einzelner Länder wissenschaftliche Studien zu neuen Medikamenten oder Impfstoffen und wägt die Risiken eines Einsatzes ab.

Mit der WHO-Notfallzulassung (EUL - Emergency Use Listing) können UN-Organisationen den Impfstoff einkaufen und verteilen. Ebenso können Länder, die keine eigenen Kapazitäten für solche wissenschaftlichen Prüfungen haben, aufgrund der Vorarbeit der WHO eine Zulassung in ihrem Land erteilen.
«Nutzen wiegt Risiken auf»
Der Impfstoff der Mainzer Firma Biontech und ihres US-Partners Pfizer erfülle alle Sicherheits- und Wirksamkeitsanforderungen der WHO, teilte die UN-Organisation mit. «Der Nutzen eines Einsatzes, um mit der Covid-19-Pandemie fertigzuwerden, wiegt mögliche Risiken auf», teilte die WHO auf Twitter mit.
The Pfizer/BioNTech #COVID19 vaccine today became the first vaccine to receive WHO validation for emergency use since the outbreak began.
— World Health Organization (WHO) (@WHO) December 31, 2020
Equitable global access to vaccines is crucial to combat the pandemic.
👉 https://t.co/7WNcHhc3z8 pic.twitter.com/Kyjv5RNzjB
Dass der Impfstoff bei minus 60 Grad oder kälter gelagert werden müsse, sei für viele Länder schwierig, so die WHO. Sie versuche, mit interessierten Regierungen Lösungen zu finden.
Für die EU hatte die Europäische Arzneimittel-Agentur (EMA) Sicherheit, Wirksamkeit und Qualität des Biontech-Impfstoffs geprüft und die vorläufige Zulassung empfohlen. Die EU-Kommission erteilte die Zulassung kurz vor Weihnachten. Als erstes Land hatte Grossbritannien den Impfstoff Anfang Dezember zugelassen.